Nella risposta delle nazioni alla pandemia globale uno dei modelli che più ha fatto discutere è stato quello svedese. Nessun lockdown feroce, nessun blocco totale del Paese, ma solo alcune indicazioni di comportamenti da mantenere in pubblico come assembramenti minimi e distanziamento fisico. La scelta di Stoccolma è stata ammirata e criticata. Al momento è prematuro capire se la variante svedese sia stata la strategia migliore, ma si possono iniziare già a fare alcune piccole valutazioni, soprattutto in materia di immunità.
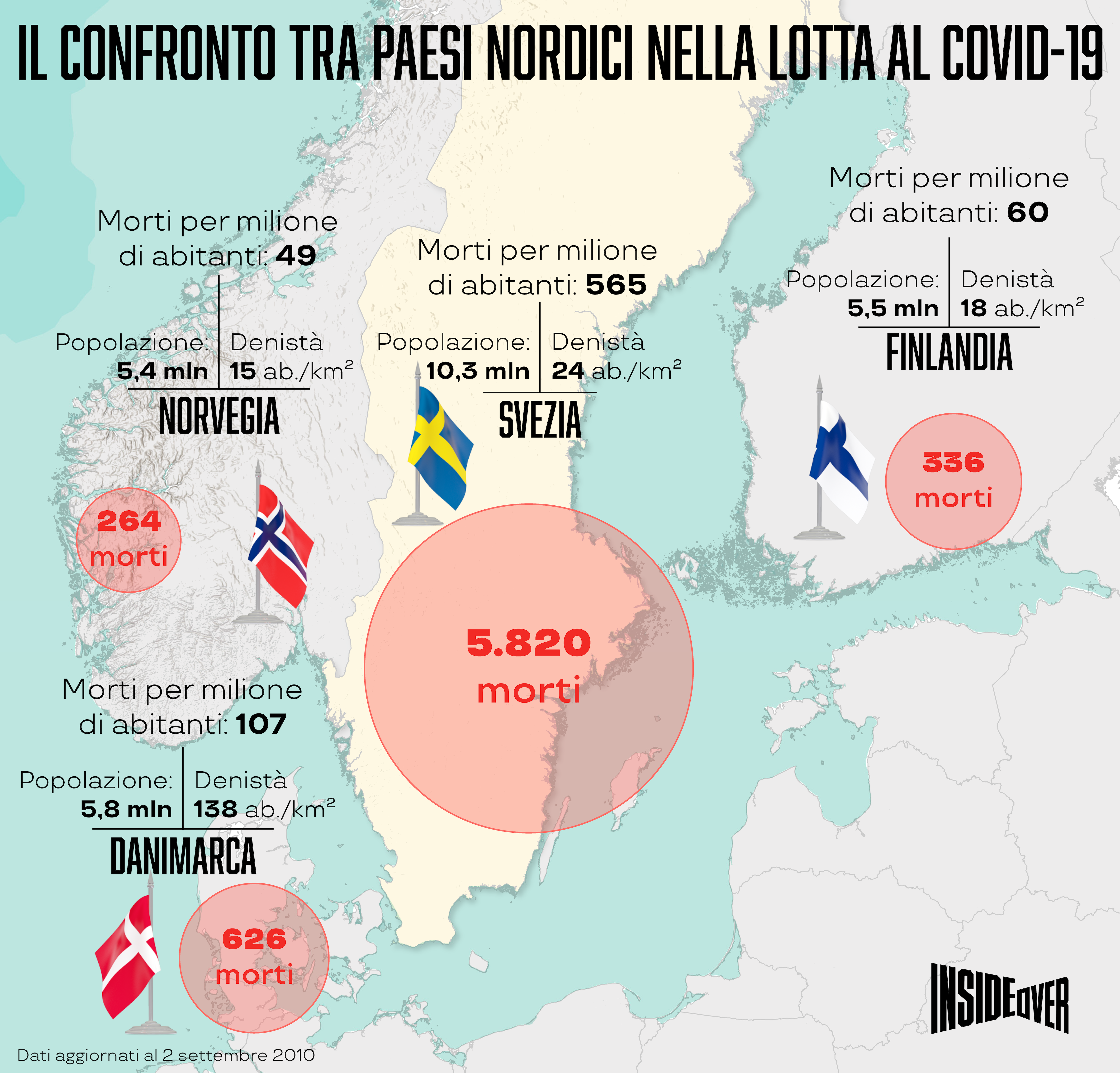
Partiamo però dai numeri. Al momento il Paese presenta 8.217 casi ogni milione di abitanti contro i 4.264 della Francia e i 4.480 dell’Italia. Anche il confronto sulla mortalità non sorride alla Svezia, in particolare se confrontata con quella dei vicini scandinavi: 565 decessi per milione di abitanti contro i 107 della Danimarca, i 60 della Finlandia e i 49 della Norvegia.
Stoccolma insiste: il modello funziona
Per l’epidemiologo di Stato Nils Anders Tegnell il confronto coi vicini è fuorviante e sbagliato. In un’intervista col sito UnHerd, l’architetto del “modello”, ha spiegato che per la mobilità della popolazione svedese e la densità delle aree urbane, la Svezia è più simile ai Paesi Bassi o al Regno Unito. Per questo, ha continuato, il lavoro fatto dalle autorità svedesi negli ultimi mesi è sicuramente positivo, dal fronte della assistenza sanitaria fino agli ospedali mai affollati.
Tegnell ha quindi passato in rassegna le scelte fatte confrontandole con chi ha deciso di puntare a un lockdown completo: “Il rapido declino dei casi che vediamo in Svezia in questo momento è un’altra indicazione che puoi ridurre il numero di casi senza avere un blocco completo”. Il punto vero non è tanto sulle aperture o chiusure, ma sul rapporto che dobbiamo avere con il virus e con la sua mortalità. “Non credo che questa sia una malattia che possiamo debellare, non con i metodi che abbiamo adesso”, ha continuato l’esperto.
“Potrebbe essere una malattia che a lungo termine possiamo sconfiggere con un vaccino, ma non ne sono sicuro. Se guardi malattie comparabili come l’influenza e altri virus respiratori, non siamo nemmeno vicini a debellarli nonostante esistano dei vaccini. Personalmente credo che questa sia una malattia con cui dovremo imparare a convivere”.
Per questo la questione della mortalità va legata con altri aspetti: “Le morti non sono così strettamente collegate alla quantità di casi che hai in un paese. Ci sono tante altre cose che le influenzano. Quale parte della popolazione viene colpita? Sono gli anziani? Quanto bene puoi proteggere le persone nelle tue strutture? In che modo il tuo sistema sanitario continua a funzionare? Quelle cose influenzano la mortalità molto di più dell’effettiva diffusione della malattia”.
La questione dell’immunità
Intanto i primi dati sull’andamento dei contagi forniscono nuove indicazioni. “Quello che vediamo in questo momento”, aggiunge Tegnell, “è una rapida diminuzione del numero di casi e deve essere coinvolta una sorta di immunità in quanto nient’altro è cambiato”. Il punto è di che immunità si sta parlando. Il recente caso di un paziente di Hong Kong risultato positivo una seconda volta ha fatto suonare l’allarme sulla durata dell’immunità.
Uno studio del King’s College di Londra ha dimostrato che su 90 pazienti che avevano contratto il virus solo il 17% aveva mantenuto inalterata la potenza della risposta immunitaria. Un secondo lavoro pubblicato su Nature Medicine aveva raggiunto conclusioni simili e cioè che gli anticorpi contro il Sars-CoV-2 diminuiscono in appena 2-3 mesi. Come si conciliano quindi queste rivelazioni con le dichiarazioni di Tegnell? Almeno tre ricerche pubblicate nelle ultime settimane gettano nuova luce sul processo di immunità.
Un lavoro del Karolinska Institute di Stoccolma, pubblicato sul giornale scientifico Cell, si è concentrato sulla cosiddetta immunità mediata dalle cellule T, note anche come linfociti T. “Questi linfociti”, ha spiegato Marus Buggert, uno dei ricercatori che ha preso parte al lavoro, “sono un tipo di globuli bianchi specializzati nel riconoscimento delle cellule infettate da virus e sono una parte essenziale del sistema immunitario”. Buggert ha evidenziato come lo studio condotto su circa 200 persone con sintomi lievi di Covid o addirittura asintomatiche, abbia mostrato come circa il doppio delle persone abbiano sviluppato l’immunità dei linfociti T rispetto a quelle nelle quali era possibile individuare anticorpi.
Soo Aleman, altro membro del team di ricerca, ha messo induce un aspetto molto interessante, “nei casi osservati non erano solo gli individui con Covid a mostrare l’immunità dei linfociti T, ma anche molti dei familiari asintomatici esposti”. Non solo: “Circa il 30% delle persone esaminate che avevano donato sangue a maggio 2020 aveva cellule T specifiche per Covid, una cifra molto più alta rispetto a precedenti test anticorpali”».
Come funziona l’immunità delle cellule T
Per capire meglio il meccanismo prendiamo due persone infette da Sars-CoV-2, una malata in modo grave e una in modo più leve. La prima sviluppa una forte risposta dei linfociti T e una grande produzione di anticorpi. Nella seconda è invece più difficile individuare la risposta anticorpale, mentre è molto più netta la riposta dei linfociti.
Uno studio della Duke-NUS Medical School, in collaborazione con National University of Singapore, è arrivato a una conclusione analoga, cioè ha rilevato la presenza di cellule T contro il nuovo coronavirus in oltre il 50% dei soggetti esaminati. Non solo. Metà dei casi considerati che nel corso della loro vita avevano contratto solo coronavirus del raffreddore manifestavano linfociti T specifici per il Sars-Cov-2.
1) Infection with #SARSCoV2 induces virus-specific T cells
2) Patients recovered from #SARS 17 years ago still possess virus-specific memory T cells displaying cross-reactivity to #SARSCoV2
(2/5) pic.twitter.com/2NGkzDXC1Z— Bertoletti Lab (@bertoletti_lab) July 15, 2020
Nel luglio scorso Antonio Bertoletti, scienziato della Duke-Nus, aveva spiegato a AdnKronos che “diversi tipi di coronavirus hanno sempre circolato tra gli umani. È possibile che un’immunità a virus strettamente correlati possa ridurre la vulnerabilità o alterare la gravità della malattia”. In una terza ricerca del La Jolla Institute of Immunology di San Diego si legge anche che nel sangue di una percentuale di persone che non sono mai entrate in contatto con il nuovo coronavirus ci sono cellule T in grado di reagire con il nuovo patogeno. In un articolo su MedicalFacts Roberto Burioni ha spiegato che non è chiara l’origine di questi linfociti ma che potrebbero derivare da vecchi coronavirus HCoV-OC43, HCoV-HKU1, HCoV-NL63 e HCoV-229E.
A questo punto sorge spontanea una domanda: perché le ricerche non si concentrano su questi linfociti T? Il problema è che le analisi su queste cellule è più complicata da eseguire rispetto ai test sugli anticorpi e per questo questi studi sono ancora in fase embrionale. Lo stesso Buggert del Karolinska Institute ha ribadito che è necessario effettuare studi più ampi sia sui linfociti T che sugli anticorpi per capire quanto sia duratura l’immunità e come siano correlati questi diversi componenti dell’immunità.
Anders Tegnell intanto chiede alla comunità scientifica di avere pazienza nel valutare i benefici delle chiusure soft in Svezia, ma si dice sicuro che l’eventuale seconda ondata sarà più facile da contenere: “Penso sia probabile che questo tipo di focolai sia più facile da limitare in Svezia perché c’è l’immunità nella popolazione”.
Le domande restano molte: l’immunità tramite linfociti T protegge da una nuova infezione? E se sì per quanto tempo? Ma soprattutto l’azione di queste cellule contro il nuovo coronavirus protegge solo l’ospite o impedisce al virus di trasmettersi ad altri. “È un lavoro difficile (l’immunità cellulare è molto complicata da valutare)”, conclude Burioni, “ma potrebbe portarci a risultati di eccezionale importanza che potrebbero avere dei risvolti pratici decisivi”.



